Atom Karbon
Atom karbon adalah atom penyusun unsur kimia karbon (simbol C) dengan nomor atom 6. Sebagai unsur golongan 14 (golongan karbon) di periode 2 pada tabel periodik, atom karbon merupakan unsur nonlogam tetravalen dengan konfigurasi elektron dasar 1s² 2s² 2p². Hal ini berarti atom karbon memiliki empat elektron valensi pada kulit terluarnya. Keempat elektron valensi ini memungkinkan atom karbon membentuk hingga empat ikatan kovalen dengan atom lain. Sifat tetravalen inilah yang membuat karbon mampu membentuk berbagai senyawa kompleks, mulai dari senyawa organik sederhana seperti metana (CH₄) hingga molekul biologis yang rumit.
Struktur Elektron Atom Karbon
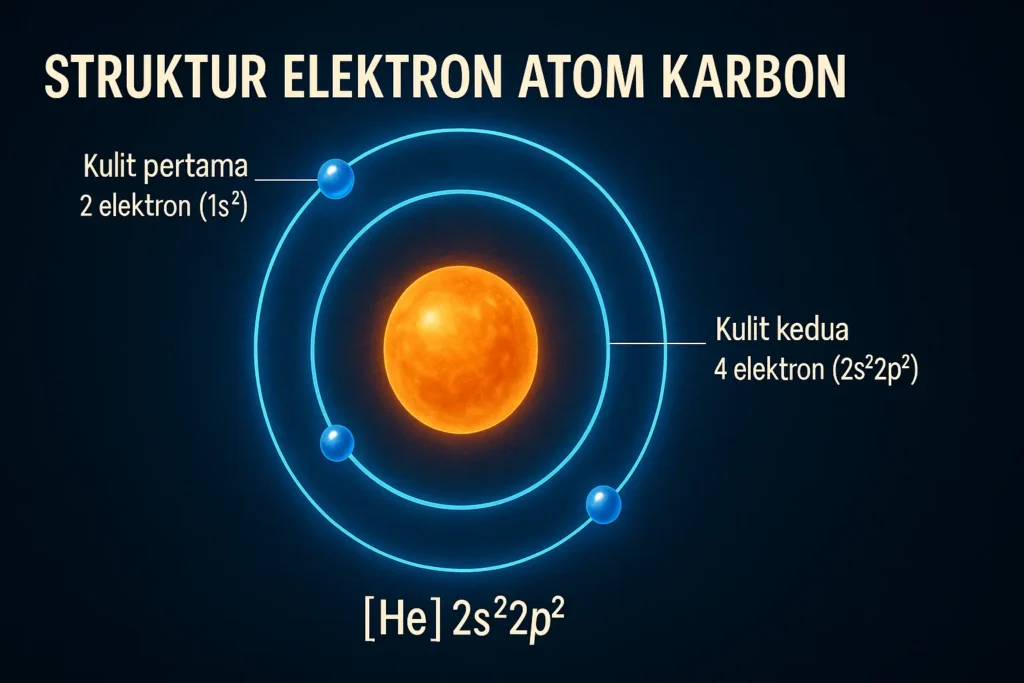
Dalam atom karbon, elektron tersebar pada dua kulit atom. Kulit pertama (inti) berisi dua elektron (1s²), sedangkan kulit kedua berisi empat elektron (2s²2p²). Konfigurasi elektron ini sering ditulis sebagai [He] 2s²2p², yang menunjukkan orbital s penuh dan dua elektron di orbital p. Keempat elektron pada kulit terluar adalah elektron valensi yang berperan dalam pembentukan ikatan kimia. Atom karbon memiliki jari-jari atom yang relatif kecil, sehingga elektron valensinya dekat dengan inti dan mudah berikatan dengan elektron valensi atom lain. Dengan konfigurasi elektron dan valensi tersebut, atom karbon dapat mengadopsi hibridisasi orbital sp³, sp², atau sp untuk membentuk geometri tetrahedral (misalnya pada metana), trigonal planar (pada etena), atau linear (pada etuna) sesuai kebutuhan ikatannya.
Sifat Kimia dan Ikatan Karbon
Karbon dikenal memiliki empat elektron valensi yang stabil. Sifat inilah yang memungkinkannya membentuk berbagai jenis ikatan kovalen. Beberapa sifat khas atom karbon antara lain:
- Empat Ikatan Kovalen: Atom karbon bersifat tetravalen, yakni dapat membentuk hingga empat ikatan kovalen dengan atom lain. Misalnya, karbon dapat berikatan tunggal dengan empat atom hidrogen membentuk metana (CH₄). Elektron valensi tersebut digambarkan sebagai “tangan ikatan” yang dapat saling bertukar pasangan elektron dengan atom lain untuk mencapai konfigurasi mirip gas mulia.
- Ikatan Rangkap dan Rantai: Keempat elektron valensi karbon juga memungkinkan pembentukan ikatan rangkap (ganda dua atau tiga) antar karbon. Karbon dapat berikatan rangkap dua (dua pasangan elektron ikatan) atau rangkap tiga (tiga pasangan) dengan atom karbon lain atau atom heteroatom. Kekuatan ikatan ganda ini menghasilkan senyawa tak jenuh seperti alkuna dan alkena. Selain itu, sifat katenasi karbon memungkinkan terbentuknya rantai karbon sangat panjang dan bercabang. Berikut adalah jenis-jenis ikatan yang umum pada atom karbon:
- Ikatan tunggal: Setiap atom karbon terikat satu pasangan elektron dengan atom lain (contoh: –C–C–).
- Ikatan rangkap dua: Setiap atom karbon terikat dua pasangan elektron dengan atom lain (contoh: =C=C=).
- Ikatan rangkap tiga: Setiap atom karbon terikat tiga pasangan elektron dengan atom lain (contoh: –C≡C–).
- Kompak dan Stabil: Jari-jari atom karbon yang kecil membuat orbital valensi karbon relatif dekat ke inti, sehingga ikatan yang terbentuk lebih kuat dan stabil. Akibatnya, karbon dapat berikatan kuat dengan banyak unsur seperti H, O, N dan terutama dengan atom karbon lain. Kekuatan ikatan karbon–karbon ini serta kemampuannya membentuk struktur bercabang memungkinkan lebih banyak senyawa yang mengandung karbon dibanding unsur lain.
Karbon juga membentuk berbagai senyawa organik yang melimpah di alam. Hampir sepuluh juta senyawa karbon telah diketahui, mencakup hidrokarbon (CnH2n+2, CnH2n, CnH2n-2) dan turunannya. Senyawa tersebut termasuk alkana, alkena, alkuna, aromatik, hingga polimer kompleks. Keunikan atom karbon yang dapat bersenyawa sangat beragam menjadikannya unsur fundamental bagi biokimia dan industri kimia.
Isotop Atom Karbon
Atom karbon memiliki tiga isotop alami utama. Dua di antaranya stabil, yaitu karbon-12 (^12C) dan karbon-13 (^13C), serta satu radioaktif yaitu karbon-14 (^14C). Isotop ^14C terbentuk di atmosfer atas melalui interaksi sinar kosmik dengan nitrogen dan meluruh dengan waktu paruh sekitar 5.730 tahun. Kaidah ini memungkinkan penentuan usia benda organik hingga puluhan ribu tahun melalui penanggalan radiokarbon. Misalnya, para ilmuwan menggunakan rasio ^14C/^12C untuk menentukan umur fosil atau artefak organik dengan akurasi hingga sekitar 40.000 tahun. Selain itu, isotop karbon-13 (^13C) sering digunakan dalam spektroskopi NMR untuk mempelajari struktur molekul organik.
Karbon dalam Kehidupan dan Lingkungan
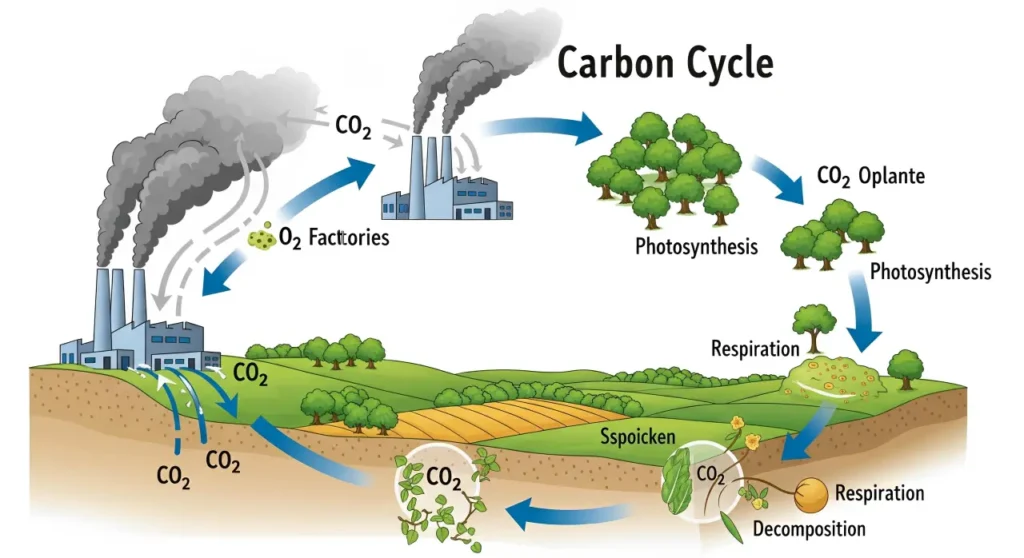
Karbon adalah unsur esensial bagi semua bentuk kehidupan di Bumi. Ilustrasi di atas menggambarkan emisi karbon dioksida (CO₂) dari aktivitas industri. Dalam siklus karbon global, emisi CO₂ dari pembakaran bahan bakar fosil masuk ke atmosfer. Selanjutnya, tumbuhan menyerap CO₂ melalui fotosintesis dan menggunakannya untuk membentuk biomassa organik. Karena karbon merupakan unsur paling melimpah ke-4 di alam semesta dan unsur ke-2 terbanyak dalam tubuh manusia sekitar 18,5% massa, setelah oksigen, siklus pertukaran karbon antara atmosfer, lautan, dan organisme hidup sangat penting bagi ekosistem. Proses pertukaran karbon ini membentuk siklus karbon yang menjaga keseimbangan kadar karbon dioksida dan mendukung kehidupan.
Secara struktural, atom karbon juga mendukung berbagai bentuk alotrop. Karbon dalam bentuk grafit dan intan merupakan contoh allotrop berbeda yang dihasilkan dari susunan ikatan kovalen karbon yang berlainan. Grafit terdiri dari lapisan atom karbon berikatan trigonal (tiga ikatan) sehingga bersifat lunak dan konduktif, sedangkan intan memiliki struktur kubus tetrahedral empat ikatan karbon yang sangat keras. Selain itu, karbon amorf dan fulleren juga merupakan allotrop yang unik. Semua allotrop ini mencerminkan fleksibilitas ikatan atom karbon.
Secara keseluruhan, atom karbon dengan konfigurasi elektron dan kemampuannya berikatan kovalen empat tangan membentuk dasar kimia kehidupan. Keunikan sifat-sifat atom karbon seperti elektron valensi 4, jari-jari atom kecil, kemampuan katenasi, dan kehadiran isotop stabil/ radioaktif menjadikannya unsur sentral dalam kimia organik, biologi, dan geologi.
Daftar Referensi:
- Karbon – Wikipedia Bahasa Indonesia. Wikipedia Contributors; Dipublikasikan 10 April 2017.
- Mengenal Kekhasan Atom Karbon serta Strukturnya – detikEdu. detikEdu; Dipublikasikan 19 November 2021.
- Mengenal Kekhasan Atom Karbon | Kimia Kelas 11 – Ruangguru Blog. Fahri Abdillah; Dipublikasikan 22 Desember 2017.
- Carbyne: from the elusive allotrope to stable carbon atom wires – arXiv. Carlo S. Casari & Alberto Milani; Dipublikasikan 23 Januari 2018.

